Gynäkologische
Tumorimmunologie
AG Prof. Dr. med. Holger Bronger
Das körpereigene Immunsystem ist eine an sich effektive Waffe im Kampf gegen Krebserkrankungen. Allerdings entwickeln Tumore verschiedene Möglichkeiten, die ihnen helfen, sich einer solchen Immunintervention wirkungsvoll zu entziehen. Die Klärung dieser sog. Immune escape-Mechanismen hat in den letzten zwei Jahrzehnten zur Entwicklung völlig neuartiger Immuntherapien geführt. Grundvoraussetzung für den Erfolg all dieser Therapien ist es jedoch, dass die Immuneffektorzellen überhaupt ihren Weg in den Tumor finden. Unsere Arbeitsgruppe untersucht, wie die Infiltration von Immunzellen in solide Tumoren gesteuert wird, und wie man dadurch Immuntherapien insbesondere bei gynäkologischen Krebserkrankungen verbessern kann. Die von uns untersuchten Systeme spielen eine zentrale Rolle bei nahezu allen aktuell in der gynäkologischen Onkologie eingesetzten Substanzklassen, insbesondere bei PARP- und Immuncheckpoint-Inhibitoren.
Prof. Dr. med. Holger Bronger
Klinik und Poliklinik für Frauenheilkunde
Technische Universität München
Tel.: 089-4140-7721
Fax: 089-4140-4820
Mail: holger.bronger@tum.de(link sends e-mail)
- Dr. rer. nat. Tobias Dreyer (Postdoc)
- Dr. rer. nat. Vanessa Küntzel (Postdoc)
- Dorine Hamann (medizinische Doktorandin)
- Katharina Käfinger (Promotionsprogramm 'Translationale Medizin')
- Giulia Magno (Promotionsprogramm 'Translationale Medizin')
- Janna Nikonov (medizinische Doktorandin)
- Sina Nokodian (medizinische Doktorandin)
- Dr. med. Maximilian Riedel (KKF-Programm)
- Dr. med. Lukas Rief (KKF-Programm)
- Christoph Stange, M.Sc. (naturwissenschaftlicher Doktorand)
- Isabel Vogel (medizinische Doktorandin)
Regulation der Immuninfiltration im Mamma- und Ovarialkarzinom
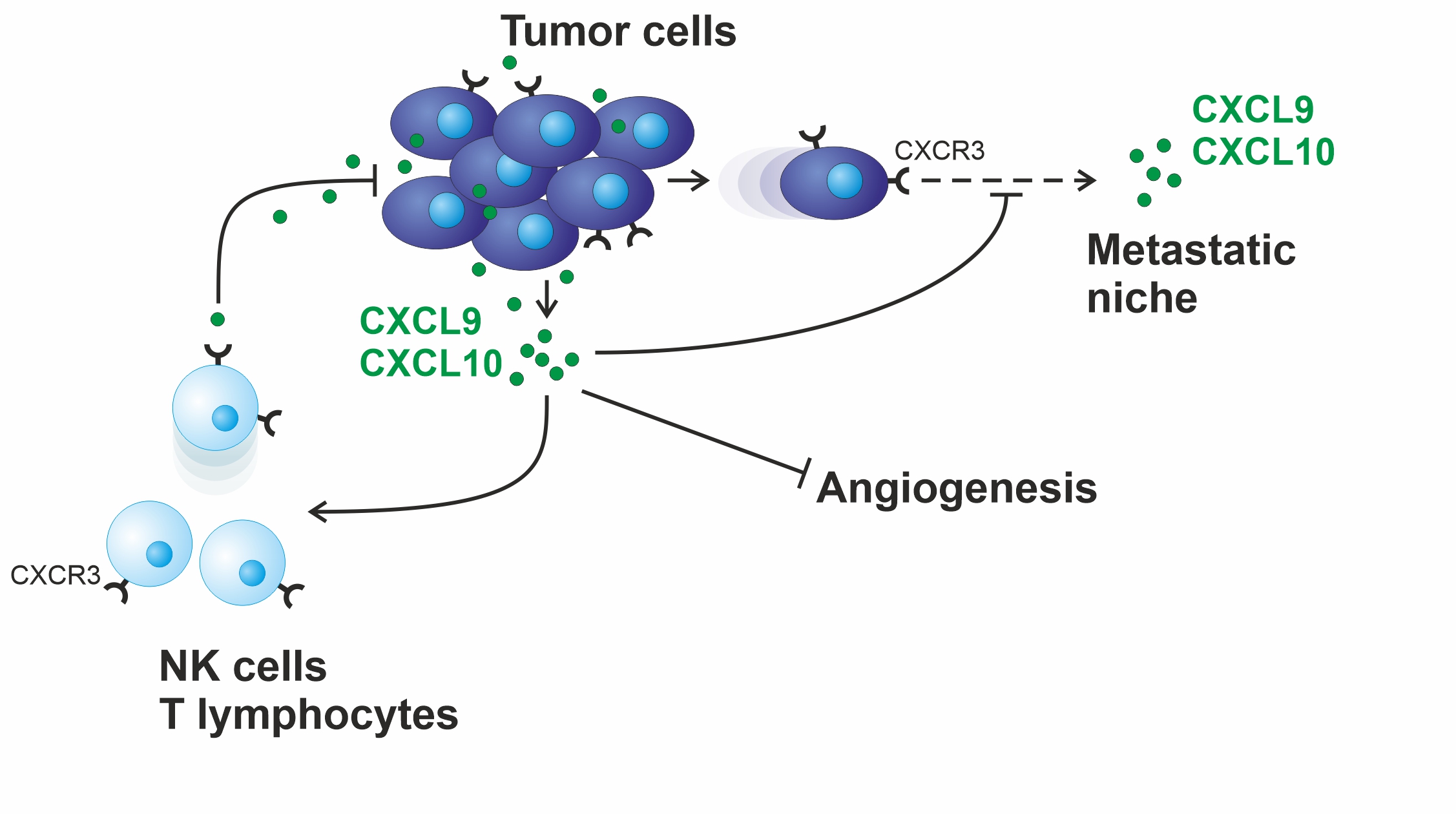 T-Lymphozyten und natürliche Killerzellen (NK-Zellen) sind in der Lage, Tumorwachstum zu bekämpfen. Sie sind darüber hinaus essentiell für die Wirkung zahlreicher moderner Therapien, so z.B. Immuncheckpoint-Inhibition, PARP-Inhibition oder für die Therapie mit monoklonalen Antikörpern. Die Chemokine CXCL9 und CXCL10, die beide den CXCR3-Rezeptor auf der Oberfläche dieser Immunzellen aktivieren, sind verantwortlich für deren chemotaktische Rekrutierung in solide Tumore. Beginnend mit der Erstbeschreibung dieser Proteine als robuste, unabhängige prognostische Marker im Ovarialkarzinom untersuchen wir gegenwärtig ihre Funktion in syngenen Mausmodellen. Unser Hauptaugenmerk liegt dabei auf der Frage, ob diese Chemokine tatsächlich in der Lage sind, die oben genannten Therapien zu verbessern.
T-Lymphozyten und natürliche Killerzellen (NK-Zellen) sind in der Lage, Tumorwachstum zu bekämpfen. Sie sind darüber hinaus essentiell für die Wirkung zahlreicher moderner Therapien, so z.B. Immuncheckpoint-Inhibition, PARP-Inhibition oder für die Therapie mit monoklonalen Antikörpern. Die Chemokine CXCL9 und CXCL10, die beide den CXCR3-Rezeptor auf der Oberfläche dieser Immunzellen aktivieren, sind verantwortlich für deren chemotaktische Rekrutierung in solide Tumore. Beginnend mit der Erstbeschreibung dieser Proteine als robuste, unabhängige prognostische Marker im Ovarialkarzinom untersuchen wir gegenwärtig ihre Funktion in syngenen Mausmodellen. Unser Hauptaugenmerk liegt dabei auf der Frage, ob diese Chemokine tatsächlich in der Lage sind, die oben genannten Therapien zu verbessern.
Ovarialkarzinome haben sich in klinischen Studien als weitestgehend resistent gegenüber Immuncheckpoint-Inhibitoren gezeigt, die die Therapie anderer solider Tumore in den letzten Jahren revolutioniert haben. Tatsächlich zeigen unsere Untersuchungen, dass das Chemokin CXCL9 alleine in der Lage ist, im Tiermodell eine solche Immuntherapie auch beim resistenten Ovarialkarzinom zu ermöglichen.
Mechanismen der Peritonealmetastasierung beim Ovarialkarzinom
 Die Metastasierung von Tumorzellen innerhalb der Bauchhöhle stellt das entscheidende klinische Problem beim Eierstockkrebs dar. Allerdings sind die zugrunde liegenden Mechanismen nur sehr unzureichend aufgeklärt, so dass bislang keine zielgerichteten Therapiestrategien existieren, um eine solche Tumoraussaat einzudämmen.
Die Metastasierung von Tumorzellen innerhalb der Bauchhöhle stellt das entscheidende klinische Problem beim Eierstockkrebs dar. Allerdings sind die zugrunde liegenden Mechanismen nur sehr unzureichend aufgeklärt, so dass bislang keine zielgerichteten Therapiestrategien existieren, um eine solche Tumoraussaat einzudämmen.
In unserer Arbeitsgruppe untersuchen wir gegenwärtig, wie Eierstockkrebszellen aus dem Primärtumor ausbrechen und sich innerhalb der Bauchhöhle ausbreiten können. Wir konnten bereits zeigen, dass der CXCR3-Rezeptor die Migration von Tumorzellen hin zum intraperitonealen Milieu vermittelt. Durch Einsatz eines spezifischen anti-CXCR3-Antikörpers konnte diese Migrationsbewegung auch in Patientenproben vollständig aufgehoben werden. Zur Bearbeitung dieser Fragestellungen kommen in vitro-Methoden zur Aufklärung zellbiologischer Mechanismen und syngene Mausmodelle zur Anwendung.
Verbesserung der anti-HER2-Therapie durch membranständige Chemokine
 Antikörper gegen den HER2-Rezeptor haben die Therapie HER2-stark überexprimierender Tumore revolutioniert. Allerdings gibt es eine Vielzahl von Tumoren, die von einer solchen Therapie überhaupt nicht profitieren, obwohl sie den HER2-Rezeptor, wenn auch etwas schwächer, exprimieren. Der therapeutische anti-HER2-Antikörper Trastuzumab wirkt u.a., indem er die Tumorzellen für den Angriff durch natürliche Killerzellen markiert, ein Vorgang, der als antikörper-abhängige zelluläre Zytotoxizität bezeichnet wird (ADCC). Wir konnten kürzlich zeigen, dass das Chemokin CX3CL1 nicht nur in der Lage ist, natürliche Killerzellen in den Tumor zu locken, sondern als membranständiges Protein auch die Bindung von NK-Zellen an die Tumorzellen und deren Lyse zu verbessern. Dadurch war es uns möglich, eine Trastuzumab-Resistenz in HER2-schwach exprimierenden Tumoren im Mausmodell erfolgreich zu durchbrechen. Ziel unserer aktuellen Forschung ist es, pharmakologische Wege zu finden, dieses Chemokin in HER2-schwach exprimierenden Tumoren zu induzieren und dadurch eine effektive anti-HER2-Therapie auch für diese Tumoren zu ermöglichen.
Antikörper gegen den HER2-Rezeptor haben die Therapie HER2-stark überexprimierender Tumore revolutioniert. Allerdings gibt es eine Vielzahl von Tumoren, die von einer solchen Therapie überhaupt nicht profitieren, obwohl sie den HER2-Rezeptor, wenn auch etwas schwächer, exprimieren. Der therapeutische anti-HER2-Antikörper Trastuzumab wirkt u.a., indem er die Tumorzellen für den Angriff durch natürliche Killerzellen markiert, ein Vorgang, der als antikörper-abhängige zelluläre Zytotoxizität bezeichnet wird (ADCC). Wir konnten kürzlich zeigen, dass das Chemokin CX3CL1 nicht nur in der Lage ist, natürliche Killerzellen in den Tumor zu locken, sondern als membranständiges Protein auch die Bindung von NK-Zellen an die Tumorzellen und deren Lyse zu verbessern. Dadurch war es uns möglich, eine Trastuzumab-Resistenz in HER2-schwach exprimierenden Tumoren im Mausmodell erfolgreich zu durchbrechen. Ziel unserer aktuellen Forschung ist es, pharmakologische Wege zu finden, dieses Chemokin in HER2-schwach exprimierenden Tumoren zu induzieren und dadurch eine effektive anti-HER2-Therapie auch für diese Tumoren zu ermöglichen.
Deutsche Forschungsgemeinschaft (DFG)
Deutsche Krebshilfe
Wilhelm Sander-Stiftung
Walter Schulz-Stiftung
Else Kröner-Fresenius-Stiftung
- AGO-Forschungspreis (2018)
- Wissenschaftspreis der BGGF (2018)
- Wilhelm Sander-Preis (2015)
- Wissenschaftspreis der BGGF (2014)
- Forschungsförderpreis der DGGG (2012)
Bei Interesse an einer Master- oder Doktorarbeit schicken Sie bitte eine Bewerbung inkl. Lebenslauf per Email an Prof. Bronger (holger.bronger@tum.de(link sends e-mail)). Für eine medizinische Doktorarbeit sind zwei Freisemester (12 Monate) zwingende Voraussetzung.



